- Células presentadoras de antígenos y respuesta inflamatoria
- Farmacogenómica
- Fisiología de los procesos inflamatorios
- Genética de neoplasias linfoides
- Genética hematológica
- Genética Molecular de la hemofilia
- Hemostasia y trombosis
- Inmunología de enfermedades respiratorias
- Inmunología experimental
- Inmunidad Innata
- Inmunología oncológica
- Mutagénesis
- Oncología experimental
- Patogénesis e inmunología de procesos infecciosos
- Patogenia de infecciones virales
- Trombosis Experimental e Inmunobiología de la Inflamación

INMUNOLOGÍA DE ENFERMEDADES RESPIRATORIAS
El objetivo general del laboratorio es dilucidar los mecanismos que regulan la respuesta inmune en la tuberculosis (TB), enfermedad causada por la bacteria Mycobacterium tuberculosis. M. tuberculosis es un patógeno humano altamente virulento que infecta aproximadamente a un cuarto de la población mundial. A pesar de que la TB es una enfermedad tratable y curable, continúa siendo una de las 10 principales causas de muerte. En 2021 se registraron 10.0 millones de casos nuevos y 1.6 millones de muertes por TB en todo el mundo. La vacuna vigente contra la TB (BCG) resulta eficiente sólo contra las formas diseminadas de la TB en la edad infantil y presenta una eficacia variable en la población adulta. En 2021 se registraron 14.000 nuevos casos de TB en Argentina, constituyendo un importante problema de salud pública debido a su alta incidencia, la aparición de cepas multi-fármaco-resistentes (MDR) y extremadamente-fármacoresistentes (XDR), la coinfección con virus de la inmunodeficiencia humana (VIH) y la eficacia limitada de la vacuna BCG. La investigación e innovación en TB es de interés global y urgente y es especialmente necesario mejorar nuestro entendimiento de la respuesta inmune contra M. tuberculosis mediante la ejecución de investigaciones innovadoras con potencial traslacional para mejorar la situación sanitaria de la TB.
 Directora: María del Carmen Sasiain
Directora: María del Carmen Sasiain
Investigadora Principal CONICET.
Email: msasiain@hematologia.anm.edu.ar
- Silvia de la Barrera. Doctora en Farmacia y Bioquímica (FFB-UBA). Inv. Independiente CONICET. Contacto: sdelab@hematologia.anm.edu.ar
- Luciana Balboa. Doctora en Química Biológica (FCEN, UBA). Inv. Adjunto CONICET. Contacto: luciana_balboa@hotmail.com
- Belén Imperiale. Doctora en Farmacia y Bioquímica (FFB-UBA). Inv. Asistente CONICET. Dir. Dra. Silvia de la Barrrera. Contacto: belen_imperiale@yahoo.com.ar
- Mariano Maio. Lic. en Biotecnología (UNQ). Becario Doctoral CONICET. Dir. Dra. Luciana Balboa. Contacto: maio.mariano96@gmail.com
- Joaquina Barros. Bioquímica (UNLP). Becaria Doctoral ANPCyT. Dir. Dra. Luciana Balboa. Contacto: barrosjoaquina97@gmail.com
Alexia Maria Zuffinetti. Estudiante de Medicina (Fmed, UBA). Concurrente. Dir. Dra. Luciana Balboa
Participación de las células de la respuesta inmune innata, tales como células NK, células dendríticas y monocitos/macrófagos sobre el desarrollo de la respuesta adaptativa antígeno-específica en tuberculosis.
Investigadora responsable: María del Carmen Sasiain.
Investigación de las estrategias de evasión de la respuesta inmune por aislados clínicos locales de tuberculosis sensibles y resistentes a drogas y su relación con su dispersión en la comunidad. Investigador.
Investigadora responsable: Silvia de la Barrera
Expresión de diferentes formas de IL-22 inducida por cepas de tuberculosis multirresistente a drogas durante la Tuberculosis pulmonar activa.
Investigadoras responsables: Silvia de la Barrera / Belén Imperiale
Evaluación de la respuesta inmune en micobacteriosis no tuberculosas causadas por el complejo M. avium y M. absessus
Investigadora responsable:Belén Imperiale.
Manipulación del metabolismo de macrófagos y células dendríticas como estrategia de evasión de la respuesta inmune frente a M. tuberculosis.
Investigadora responsable: Luciana Balboa.
Mecanismos sinérgicos entre la infección por el virus de la inmunodeficiencia humana (VIH) y M. tuberculosis en macrófagos humanos.
Investigadora responsable: Luciana Balboa.
Impacto del microambiente tuberculoso sobre el control de la infección por M. tuberculosis.
Investigadora responsable: Luciana Balboa.
- Innate Immune Cells in the Control of Intracellular Bacteria. Luciana Balboa, Andres Baena and Leandro J. Carreño. Front. Cell. Infect. Microbiol., 2022
- Brucella abortus RNA does not polarize macrophages to a particular profile but interferes with M1 polarization. Serafino A, Marin Franco JL, Maio M, Trotta A, Genoula M, Castillo LA, Birnberg Weiss F, Pittaluga JR, Balboa L, Barrionuevo P, Milillo MA. PLoS Negl Trop Dis. 2022
- Human macrophage polarization shapes B. pertussis intracellular persistence. Valdez H, Marin Franco JL, Gorgojo JP, Alvarez Hayes J, Balboa L, Fernandez Lahore M, Sasiain MC, Rodriguez ME. J Leukoc Biol. 2022
- Th22 response induced by Mycobacterium tuberculosis strains is closely related to severity of pulmonary lesions and bacillary load in patients with multi-drug-resistant tuberculosis. Imperiale BR, García A, Minotti A, González Montaner P, Moracho L, Morcillo NS, Palmero DJ, Sasiain MDC, de la Barrera S. Clin Exp Immunol. 2021.
- The Cholinergic System Contributes to the Immunopathological Progression of Experimental Pulmonary Tuberculosis. Islas-Weinstein L, Marquina-Castillo B, Mata-Espinosa D, Paredes-González I, Chávez J, Balboa L, Marín-Franco JL, Guerrero-Romero D, Barrios-Payán JA and Hernández-Pando R. Front. Immunol., 2021
- SLAMF1 signaling induces Mycobacterium tuberculosis uptake leading to endolysosomal maturation in human macrophages. Barbero A, Trotta A, Genoula M, Hernández Del Pino R, Estermann M, Celano J, Fuentes F, García V, Balboa L, Barrionuevo P, and Pasquinelli V. Journal of Leukocyte Biology. 2021
- Genetic diversity of Mycobacterium avium sp. paratuberculosis by mycobacterial interspersed repetitive Unit-Variable number tandem repeat and multi-locus short-sequence repeat one-sentence summary: Genetic diversity of Mycobacterium avium sp. paratuberculosis isolates. Moyano RD, Imperiale BR, Romero M, Santangelo MP, Alvarado Pinedo MF, Travería G, Romano MI. Int J Mycobacteriol. 2021
- Effect of the deletion of lprG and p55 genes in the K10 strain of Mycobacterium avium subspecies paratuberculosis. Mariana Noelia Viale, María Alejandra Colombatti Olivieria, Natalia Alonso, Roberto Damián Moyano, Belén Imperiale, Nora Morcillo, María Paz Santangelo, William Davis, María Isabel Romano. Res Vet Sci, 2021
- Host-derived lipids from tuberculous pleurisy impair macrophage microbicidal-associated metabolic activity. J. L. Marín Franco, M. Genoula, D. Corral, G. Duette, M. Ferreyra, M. Maio, M. B. Dolotowicz, O. E. Aparicio-Trejo, E. Patiño-Martínez, F. Fuentes, V. Soldan, E. J. Moraña, D. Palmero, M. Ostrowski, P. Schierloh, C. Sánchez-Torres, R. Hernández-Pando, J. Pedraza-Chaverri, Y. Rombouts, E. Layre, D. Hudrisier, C. Vérollet, I Maridonneau-Parini, O. Neyrolles, M. C. Sasiain, G. Lugo-Villarino, L. Balboa. Cell Reports. 2020
- Fatty acid oxidation of alternatively activated macrophages prevents foam cell formation, but Mycobacterium tuberculosis counteracts this process via HIF-1α activation. Genoula M, Marín Franco JL, Maio M, Dolotowicz B, Ferreyra M, Milillo MA, Mascarau R, Moraña EJ, Palmero D, Matteo M, Fuentes F, López B, Barrionuevo P, Neyrolles O, Cougoule C, Lugo-Villarino G, Vérollet C, Sasiain MC, and Balboa L. PLOS Pathogens. 2020
- Tuberculosis-associated IFN-I induces Siglec-1 on tunneling nanotubes and favors HIV-1 spread in macrophages. Dupont M, Souriant S, Balboa L, Vu Manh TP, Pingris K, Rousset S, Cougoule C, Rombouts Y, Poincloux R, Ben Neji M, Allers C, Kaushal D, Kuroda MJ, Benet S, Martinez-Picado J, Izquierdo-Useros N, Sasiain MDC, Maridonneau-Parini I, Neyrolles O, Vérollet C, Lugo-Villarino G. Elife. 2020
- Second generation BTK inhibitors impair the anti-fungal response of macrophages and neutrophils. Colado A, Marín Franco JL, Elías EE, Amondarain M, Vergara Rubio M, Sarapura Martínez V, Cordini G, Fuentes F, Balboa L, Fernandez Grecco H, Pavlovsky M, Bezares F, Morande P, Giordano M, Gamberale R, Borge M. Am J Hematol. 2020
- A Phenotypic Characterization of Two Isolates of a Multidrug-Resistant Outbreak Strain of Mycobacterium tuberculosis with Opposite Epidemiological Fitness. Bei J, Bigi MM, Lima A, Zhang Q, Blanco FC, Lopez B, Yu T, Wang Z, Dai Z, Chen Z, Cataldi AA, Sasiain MDC, Ritacco V, De la Barrera S, Soria MA, Durán R, Bigi F. Biomed Res Int. 2020.
- Bacterial RNA Contributes to the Down-Modulation of MHC-II Expression on Monocytes/Macrophages Diminishing CD4+ T Cell Responses M. Ayelén Milillo, Aldana Trotta, Agustina Serafino, José Luis Marin Franco, Fábio V. Marinho, Julieta Alcain, Melanie Genoula, Luciana Balboa, Sergio Costa Oliveira, Guillermo H. Giambartolomei and Paula Barrionuevo Front. Immunol., 2019
- Tuberculosis boosts HIV-1 production by macrophages through IL-10/STAT3-dependent tunneling nanotube formation Souriant S, Balboa L, Pingris K, Kviatcovsky D, Cougoule C, Lastrucci C, Bah A, Gasser R, Poincloux R, Raynaud-Messina B, Al Saati T, Inwentarz S, Poggi S, Moraña EJ, GonzálezMontaner P, Corti M, Lagane B, Vergne I, Allers C, Kaushal D, Kuroda MJ, Sasiain MC, Olivier N, Maridonneau-Parini I, Lugo-Villarino G, Vérollet C. Cell Reports, 2019
- PD-1/PD-L1 Pathway Modulates Macrophage Susceptibility to Mycobacterium tuberculosis Specific CD8+ T cell Induced Death. Suarez GV, Melucci Ganzarain CDC, Vecchione MB, Trifone CA, Marín Franco JL, Genoula M, Moraña EJ, Balboa L, Quiroga MF. Sci Rep., 2019
- Surveillance and characterization of drug-resistant Mycobacterium tuberculosis isolated in a reference hospital from Argentina during 8 years’ period. Imperiale BR, Di Giulio ÁB, Mancino MB, Zumárraga MJ, Morcillo NS. Int J Mycobacteriol. 2019
- Effect of the BTK inhibitor ibrutinib on macrophage- and γδ T cell-mediated response against Mycobacterium tuberculosis. Colado A, Genoula M, Cougoule C, Marín Franco JL, Almejún MB, Risnik D, Kviatcovsky D, Podaza E, Elías EE, Fuentes F, Maridonneau-Parini I, Bezares FR, Fernandez Grecco H, Cabrejo M, Jancic C, Sasiain MDC, Giordano M, Gamberale R, Balboa L, Borge M. Blood Cancer J. 2018
- Formation of Foamy Macrophages by tuberculous pleural effusions is triggered by the IL-10/STAT3 Axis through ACAT up-regulation Genoula M, Marín Franco JL, Dupont M, Kviatcovsky D, Milillo A, Schierloh P, Moraña EJ, Poggi S, Palmero D, Mata-Espinosa D, González-Domínguez E, León Contreras JC, BarrionuevoP, Rearte B, Córdoba Moreno MO, Fontanals A, Crotta Asis A, Gago G, Cougoule C, Neyrolles O, Maridonneau-Parini I, Sánchez-Torres C, Hernández-Pando R, Vérollet C, Lugo-Villarino G, Sasiain MC and Balboa L. Frontiers in Immunology, 2018
- The C-Type Lectin Receptor DC-SIGN Has an Anti-Inflammatory Role in Human M(IL-4) Macrophages in Response to Mycobacterium tuberculosis. Lugo-Villarino G, Troegeler A, Balboa L, Lastrucci C, Duval C, Mercier I, Bénard A, Capilla F, Al Saati T, Poincloux R, Kondova I, Verreck FAW, Cougoule C, Maridonneau-Parini I, Sasiain MDC, Neyrolles O. Frontiers in Immunology, 2018
- Detection of multidrug-resistant tuberculosis from stored DNA Samples: A multicenter study. Rabodoarivelo MS, Brandao A, Cergole Novella MC, C Bombonatte AG, Imperiale B, Rakotosamimanana N, Morcillo N, Rasolofo V, Palomino JC, Martin A. Int J Mycobacteriol. 2018
- String test: A new tool for tuberculosis diagnosis and drug-resistance detection in children. Imperiale BR, Nieves C, Mancino B, Sanjurjo M, Tártara S, Di Giulio ÁB, Palomino JC, Morcillo NS, Martin A. Int J Mycobacteriol. 2018
- Crystal violet decolorization assay for rapid detection of multidrug-resistant Mycobacterium tuberculosis isolates: A multicenter study. Coban AY, Alakbarova G, Satti L, Tayyab N, Zaman G, Morcillo N, Imperiale B, Wainmayer I, Simboli N. Int J Mycobacteriol. 2018
- Premio Alejandro A. Raimondi al mejor trabajo en tisiología. Otorgado por la Academia Nacional de Medicina, 2022. Trabajo: La Glicólisis inducida por HIF-1α mejora la capacidad Migratoria de las Células Dendríticas en la Tuberculosis. Autores: Mariano Maio, Joaquina Barros, Lorena Ciallella, Rosa Musella, Pablo González Montaner, María del Carmen Sasiain, Domingo Palmero y Luciana Balboa
- Premio Internacional Latinoamericano en Neumología «Fernando Gómez y Miguel Mello Aguerre», otorgado por la Academia Nacional de Medicina del Uruguay, 27 de noviembre de 2020. Trabajo: “Alteraciones del metabolismo en macrófagos expuestos al líquido pleural tuberculoso y su impacto en el control de la infección con Mycobacterium tuberculosis». Autores: José Luis Marín Franco, Melanie Genoula, Eduardo José Moraña, Domingo Palmero, María del Carmen Sasiain, Luciana Balboa
- Premio “Dr. Leonardo Satz”. Otorgado por la Sociedad Argentina de Inmunología, 11 de octubre de 2019. Trabajo: THE PLEURAL EFFUSIONS FROM TB PATIENTS ALTER THE METABOLIC REPROGRAMMING OF HUMAN MACROPHAGES BY TARGETING HIF-1A ACTIVITY. Autores: José Luis Marín Franco, Melanie Genoula, Dan Corral, Gabriel Duette, Mariano Maio, María Belén Dolotowicz, Malena Ferreyra, Federico Fuentes, Eduardo José Moraña, Domingo Palmero, Matías Ostrowski, Olivier Neyrolles, Pablo Schierloh, María Del Carmen Sasiain, Geanncarlo Lugo-Villarino y Luciana Balboa
- Premio Alejandro A. Raimondi al mejor trabajo en tisiología. Otorgado por la Academia Nacional de Medicina, 14 de noviembre de 2019. Trabajo: Estudio del metabolismo de lípidos en distintos perfiles de activación del macrófago frente a la infección tuberculosa. Autores: Melanie Genoula, José Luis Marín-Franco, Eduardo José Moraña, Domingo Palmero, María del Carmen Sasiain y Luciana Balboa
Distinciones
- L. Balboa: Miembro de la Global Young Academy (GYA). 2021-2026
- L. Balboa: Co-presidenta de la Academia Joven de Argentina. 2022-2024
- Laboratorio Internacional Asociado entre el Institut de Pharmacologie et de Biologie Structurale (IPBS) CNRS, Francia (Dr. Neyrolles) y el IMEX-CONICET (Dr. Sasiain/Balboa). A research program to integrate immunometabolism and macrophage biology in the context of Mtb/HIV co-infection (2018-2022).
- International Research Project (IRP) otorgado por el CNRS. Proyecto: ¿Cómo el microambiente asociado a la tuberculosis exacerba la infección por VIH-1? Papel del metabolismo y la activación de los macrófagos. (2021-2025)
A)  B)
B) 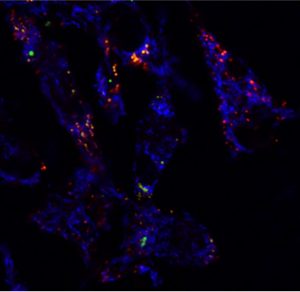 C)
C) 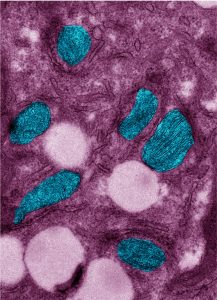 D)
D) 
A) Macrófagos humanos infectados (cuerpos lipídicos en verde, bacteria en rojo)
B) Mitocondrias en azul, ácidos grasos en rojo y cuerpos lipídicos en verde de macrófagos M2 tratados con el liquido pleural tuberculoso
C) Mitocondrias en azul y cuerpos lipídicos en blanco de macrófagos expuestos al líquido pleural tuberculoso
D) Interacción epitelio bronquial y Mycobacterium tuberculosis